beat365正版唯一官网王斌举教授课题组在全长P450TT酶的电子转移机制研究方面取得进展,相关成果以“Conformational Motion of Ferredoxin Enables Efficient Electron Transfer to Heme in the Full-Length P450TT”为题发表于《美国化学会志》(J. Am. Chem. Soc., 2021, DOI: 10.1021/jacs.0c11279)。
P450酶是多功能的生物催化剂,在天然产物的合成、药物以及异源物质的代谢方面发挥重要作用。由于其良好的催化活性和化学选择性,且具有来源广泛、易改造等优点,P450酶被广泛应用于生物合成。尽管实验和理论计算对P450酶催化机理开展了广泛的研究,其活性物种(Cpd I)生成所涉及的长程电子转移机制仍然是不清楚的。
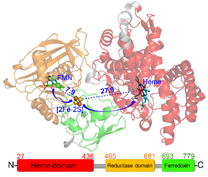
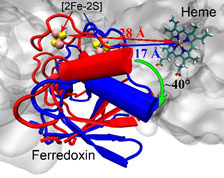
最近,第一个全长P450(P450TT)酶结晶结构被实验解析(Zhang et al., Nat. Commun. 2020, 11, 2676),使得研究其中长程的电子转移机制成为了可能。结晶结构(构象1)中,还原域FMN到[2Fe-2S]的距离为7.9埃,而[2Fe-2S]到Heme-Fe的距离为27.9埃。这表明,在结晶构象中,电子从FMN到[2Fe-2S]的传递是有利的,而从[2Fe-2S]到Heme-Fe是不利的。王斌举课题组通过分子动力学模拟和伞状采样的方法,研究发现了另外一个稳定的构象(构象2)。在该构象中,FMN到[2Fe-2S]的距离约为15埃,而[2Fe-2S]与Heme-Fe之间的距离缩短到了大约17埃。与结晶构象相比,电子传递速率提高了10万倍。通过电子传递路径的分析和结构域间的相互作用分析,研究阐明了[2Fe-2S]域与heme域之间的相互作用,并预测了对相互作用以及电子传递起关键作用的氨基酸残基。结构域之间相互作用的分析表明,P450TT酶构象的变化主要由长程的静电相互作用调控:电子转移前,[2Fe-2S]域与heme域的相互作用很强,酶更倾向于构象2;而当电子转移后,域间的长程静电相互作用变弱,酶更倾向于构象1。电子传递路径的分析表明,P450TT酶中的电子传递路径并非只有一条,而是有多条可能的路径。研究揭示了单电子载体[2Fe-2S]的构象转变驱动的长程电子传递,该图像可进一步拓展到其它P450酶以及一氧化氮合成酶中。
该工作由王斌举教授课题组博士后王展峰完成。研究工作得到国家重点研发计划(批准号:2019YFA0906400)以及国家自然科学基金(批准号:22073077、21933009、21907082)的资助和支持。
论文链接:https://pubs.acs.org/doi/10.1021/jacs.0c11279
